В каких случаях возможна геометрическая изомерия. Изомерия
Изомеры - вещества с одинаковым строением молекулы, но разными химическим строением и свойствами.
Виды изомерии
I . Структурная - заключается в различной последовательности соединения атомов в цепи молекулы:
1) Изомерия цепи
Следует отметить, что атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным , с двумя другими атомами углерода - вторичным , с тремя - третичным , с четырьмя - четвертичным .
2) Изомерия положения

3) Изомерия межклассовая
4) Таутомерия
Таутомери́я (от греч. ταύτίς — тот же самый и μέρος — мера) — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении.
II. Пространственная (стерео) - обусловлена различным положением атомов или групп относительно двойной связи или цикла, исключающих свободное вращение соединённых атомов углерода
1. Геометрическая (цис -, транс - изомерия)

Если атом углерода в молекуле связан с четырьмя различными атомами или атомными группами, например:
то возможно существование двух соединений с одинаковой структурной формулой, но отличающихся пространственным строением. Молекулы таких соединений относятся друг к другу как предмет и его зеркальное изображение и являются пространственными изомерами.
Изомерия этого вида называется оптической, изомеры - оптическими изомерами или оптическими антиподами:
Молекулы оптических изомеров несовместимы в пространстве (как левая и правая руки), в них отсутствует плоскость симметрии.
Таким образом,
- оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.

Оптические изомеры аминокислоты
3. Конформационная изомерия
Следует отметить, что атомы и группы атомов, связанные друг с другом σ -связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга.
Молекулы, имеющие одинаковое строение и различающиеся пространственным расположением атомов в результате вращения вокруг С-С связей, называются конформерами.
Для изображения конформационных изомеров удобно пользоваться формулами - проекциями Ньюмена:
Явление конформационной изомерии можно рассмотреть и на примере циклоалканов. Так, для циклогексана характерны конформеры:
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C2 H6 O соответствуют два вещества с разными структурными формулами - этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт - жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,50С. При тех же условиях диметиловый эфир - газ, не реагирующий с натрием, кипит при -230С.
Эти вещества отличаются своим строением - разным веществам соответствует одинаковая молекулярная формула.

Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» - «равный» и «мерос» - «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир - структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой . Рис. 1.
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C5H12 соответствуют три разных углеводорода. Это изомерия углеродного скелета . Рис. 2.

Рис. 2 Примеры веществ - структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения .
Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4

Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах - по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.



Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру - тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия . Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью - от греческого с hier - «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios - «противоположный» и meros - «часть»), а оптические изомеры - энантиомерами . Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d- , или (+)-изомер, - вправо, l- , или (-)-изомер, - влево. Смесь равных количеств энантиомеров, называемая рацематом , оптически недеятельна и обозначается символом d,l- или (±).
ИСТОЧНИКИ
источник видео - http://www.youtube.com/watch?v=mGS8BUEvkpY
http://www.youtube.com/watch?t=7&v=XIikCzDD1YE
http://interneturok.ru/ru/school/chemistry/10-klass - конспект
источник презентации - http://ppt4web.ru/khimija/tipy-izomerii.html
http://www.youtube.com/watch?t=2&v=ii30Pctj6Xs
http://www.youtube.com/watch?t=1&v=v1voBxeVmao
http://www.youtube.com/watch?t=2&v=a55MfdjCa5Q
http://www.youtube.com/watch?t=1&v=FtMA1IJtXCE
источник презентации - http://mirhimii.ru/10class/174-izomeriya.html
Геометрические изомеры возникают, если свободное вращение атомов в молекуле ограничено вследствие наличия двойной связи. Примером такой пары изомеров могут служить малеиновая (12.23) и фумаровая (12.24) кислоты (цис- и транс- соответственно).
По химическому строению геометрические изомеры очень похожи, но они не являются зеркальными отображениями друг друга и не вращают плоскость поляризации света. Как правило, цис- и транс-изомеры значительно отличаются по физическим свойствам. Например, малеиновая кислота (12.23) плавится при 130 °С, величина ее рКа 1,9, она очень хорошо растворима в холодной воде (79 г на 100 мл); константы ее геометрического изомера - фумаровой кислоты (12.24) соответственно 287 °С, 3,0 и 0,7 г на 100 мл. Неудивительно, что геометрические изомеры обладают разными биологическими свойствами и поэтому очень важно при изучении химической формулы нового соединения учитывать все возможности существования изомерии такого типа.
Цис- и транс-изомеры можно легко разделить кристаллизацией или хроматографически. Общего метода для превращения одного изомера в другой не существует, однако при нагревании, как правило, образуется наиболее стабильный изомер, а под действием света - менее стабильный. Зрение человека зависит от превращения 11-цис-изомера ретиналя в 11-транс-форму под действием света. Как только возбуждающий луч света исчезает,
этот каротиноидный пигмент снова переходит в цис-форму, прерывая тем сй^ым идущий к мозгу импульс .
Цис- и транс-изомеры существуют и у плоского циклопентанового кольца, представляющего собой как бы большую двойную связь. Хотя циклогексановое кольцо вообще не плоское, оно тем не менее достаточно плоское для образования цис- и трансизомеров. Так, существуют и доступны как цис- (12.25), так и транс- (12.26) формы диаминоциклогексана. Одна и та же молекула может образовывать и геометрические, и оптические изомеры. Например, транс-изомер (12.26) может быть разделен на (S,S) (12.27) и (R,R) (12.28) хиральные изомеры. Однако цис-изомер на хиральные формы разделен быть не может, так как в нем существует плоскость симметрии. У бензольного кольца нет геометрических изомеров, так как у каждого атома углерода кольца только один заместитель.
Стереоизомеры 1,2-диаминоцинлогенсана
Иногда бывает трудно выбрать два из четырех заместителей при двойной связи для определения цис- или транс-конфигурации. Правило последовательности предписывает выбирать заместителей с наиболее тяжелыми атомами, при этом цис-форма обозначается буквой Z (от немецкого слова zusammen), а трансформа- буквой Е (entgegen). Иногда в названиях соединений, в которых геометрическая изомерия может проявиться многократно, заместитель, имеющий самый маленький номер (по правилу нумерации), обозначают буквой г, а обозначения с-(цис) и t-(транс) перед другими заместителями показывают их положение по отношению к г-заместителю.
Аналогично индол-3-илуксусной кислоте (4.82), стимулирующей рост растительных клеток, могут действовать и другие карбоновые кислоты, карбоксильная группа которых находится под углом к плоскости ароматического кольца. Геометрическая изомерия ограничивает возможность такого расположения двух заместителей, поэтому из коричных кислот активен только цисизомер . У 2-фенилциклопропан-1- карбоновой и 1,2,3,4-тетрагидронафталиден-1-уксусной кислот также активны только цис-изомеры . На молекулярных моделях видно, что кольцо и карбоксильная группа в транс-изомере (неактивном) этих веществ лежат в одной плоскости, в то время как в цис-форме (активной) они некопланарны. Впервые указал на эту связь между
некопланарностью и стимулирующей рост активностью Veidstra. Некопланарность может возникнуть и вследствие стерических препятствий. Так, бензойная кислота имеет плоскую форму и не активна, а 2,6-дихлорбензойная и 8-метил-1-нафтойная кислоты непланарны и биологически активны .
В аналогах ауксинов карбоксильная группа может быть заменена и на другие электроноакцепторные группы (-CN, -NO 2 , -SO3H), при этом биологическая активность лишь незначительно уменьшается. О связи между структурой и действием в этой серии см. Koepfli, Thimann, Went (1938) и Veidstra (1963).
Геометрическая изомерия стероидов заслуживает специального рассмотрения. На формуле (12.29) приведена общая структура этой группы природных насыщенных соединений (показана нумерация атомов углерода и буквенные обозначения четырех циклов). В природных стероидах кольца В и С находятся в транс-сочленении, причем оба они закреплены в конформации кресла. В сердечных гликозидах сочленение циклов С и D имеет цис-конфигурацию, но в гормонах животных, стеринах и желчных кислотах - транс-сочленение. У большинства биологически активных стероидов кольца А и В находятся в транс-сочленении («5а»-ряд, называвшийся ранее «алло»). Каждое из колец в молекуле стероидов образует складки, что хорошо видно на боковой проекции формулы (12.30).

Обозначение «5а» говорит о том, что атом водорода в положении 5 находится ниже общей плоскости колец. Все заместители, расположенные ниже этой плоскости, обозначаются символом «а», а выше - символом «р». а-Заместители обозначают пунктирными линиями, а ^-заместители - сплошными. Символы а- и ^-используют и для других полициклических соединений, например, тритерпенов и алкалоидов. Сложность строения этих соединений затрудняет использование R- и S-номенклатуры.
Как правило, у млекопитающих высокая биологическая активность стероидных соединений связана с отсутствием а-заме- стителей в положениях 1, 9, 11-13, 17 и отсутствием р-замести- телей в положениях 4-8, 14, 15. Боковая проекция молекулы гидрокортизона иллюстрирует это правило . Первой стадией в биологическом действии стероидных гормонов является их влияние на специфический транспорт белков (разд. 2.4). Предполагают, что с белками стероиды взаимодействуют плоской нижней стороной (a-поверхность) молекулы.
Различные стероиды отличаются друг от друга в основном заместителями R 1 , R 2 и R 3 (12.29), но иногда и степенью нена- сыщенности или наличием других заместителей вне колец. Для того чтобы стероид обладал прогестиновой, андрогенной и кор- тикоидной активностью, как правило, необходимо наличие циклогексеноновой структуры кольца А. Для проявления активности кортизонового типа необходимы атомы кислорода в положениях 3, 11 и 17 и характеристичная группа -СО-СН 2 ОН в положении 17. Андрогенная и кортикоидная активность в большей степени зависит от этих деталей строения молекулы, однако прогестиновая активность сохраняется, если ацетильная группа в положении 17 находится в a-конфигурации, не встречающейся в природных соединениях, а замена метильной группы в положении 18 на этильную приводит даже к усилению этой активности (пероральный контрацептив норгестрел).
Из всех стероидных гормонов наименее жесткие требования к структуре предъявляют соединения, обладающие эстрогенной активностью. При условии ароматизации кольца А и наличии кислой гидроксильной группы в положении 3 строение остальной части молекулы имеет второстепенное значение. В 1938 г. появились простые высокоэффективные бензольные аналоги стероидных эстрогенов. Хотя считалось, что их молекулы по форме похожи на молекулы стероидов, в действительности между ними не так уж много общего. По данным рентгеноструктурного анализа молекула диэтилстильбэстрола (12.31) имеет транс-конфигурацию, искаженную из-за стерических затруднений, создаваемых метиленовыми фрагментами двух этильных групп. Поэтому два бензольных кольца образуют с этиленовым фрагментом двугранный угол 63°, что делает форму молекулы совершенно не похожей на стероидную. Однако в этих молекулах примерно одинаково расстояние между атомами кислорода: 1,21 нм в диэтилстильбэстроле и от 1,07 до 1,11 нм в стероидных эстрогенах, но все эти молекулы слишком жесткие и поэтому не способны взаимодействовать с одним и тем же рецептором, в котором фиксировано расстояние между точками связывания. Известно, что для проявления эстрогенной активности необходимо образование двух водородных связей рецептора с атомами кислорода лиганда, следовательно, рецептор должен обладать определенной гибкостью . Oki, Urushibara (1952) впервые отметили, что действие диэтилстильбэстрола связано и с толщиной его молекулы, которая составляет 0,45 нм и равна толщине молекул стероидных эстрогенов .

Диэтилстильбэстрол 3,4-ди (4-гидроксифенил) гекс-3-ен
(12.31), эффективный и недорогой заменитель основного женского гормона эстрадиола (12.32), появился в 1938 г. . Этот синтетический лекарственный препарат, отличающийся от природного гормона высокой эффективностью при пероральном применении и большей длительностью действия, стал основным препаратом в эндокринной терапии. Некоторое недоверие к этому препарату возникло на основании двух факторов: во-первых, его неограниченно применяли для увеличения веса сельскохозяйственных животных, а во-вторых, были отмечены случаи заболевания раком у женщин, матери которых принимали его во время беременности. Несмотря на это, диэтилстильбэстрол продолжают широко применять и считают безопасным средством; его не назначают только в первые три месяца беременности (что, кстати, в равной степени относится и к природному гормону). О применении его фосфата для лечения рака предстательной железы см. разд. 4.2. Сходными эстрогенными свойствами обладает и дигидропроизводное диэтил- стильбэстрола-синэстрол (12.33, а) (конфигурация 3R, 4S). С эстрогенсвязывающим белком (разд. 2.4) он соединяется сильнее, чем сам диэтилстильбэстрол, а еще сильнее взаимодействует с этим белком его низший гомолог-норгексэстрол (12.33, б) .
Сердечные гликозиды рассматриваются в разд. 14.1. Подробное изложение химии и стереохимии стероидов см. Shoppee (1964), биохимии и фармокологии - Briggs, Christie (1977).
Геометрическая изомерия 4-аминокротоновой кислоты, которая помогла определить активную конформацию нейромедиатора гамма-аминомасляной кислоты, рассматривается в разд. 12.7.
Изомерия лигандов
Изомерия лигандов подразделяется на связевую (которая определяется разным типом координации одного и того же лиганда), и собственно изомерию лиганда.
Примерами связевой изомерии может служить существование нитро- и нитрито-комплексов кобальта(III) состава K 3 и K 3 , в которых координация лиганда NO 2 - осуществляется, соответственно, через атом азота или атом кислорода. Другой пример – координация тиоцианат-иона NCS - через атом азота или через атом серы, с образованием тиоцианато-N- или тиоцианато-S-комплексов.
Кроме того, лиганды сложного строения (например, аминокислоты) могут сами по себе образовывать изомеры, координация которых ведет к образованию комплексов одинакового состава с разными свойствами.
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды.
Комплексные соединения с тетраэдрическим, треугольным и линейным строением геометрических изомеров не имеют, поскольку места расположения лигандов двух разных видов вокруг центрального атома равноценны.
Комплексы, имеющие строение плоского квадрата, при наличии двух разных лигандов L ′ и L ′′ уже могут иметь два изомера (цис- и транс-):
Примером комплексного соединения, имеющего цис- и транс-изомеры, может служить дихлородиамминплатина(II):
Отметим, что комплексное соединение состава со структурой плоского квадрата не может иметь изомеров: положение лиганда L ′′ равновероятно в любом углу квадрата. Когда же появляется два разных лиганда, то уже возможно существование двух изомеров (цис- и транс-), отличающихся по свойствам. Так, цис-дихлородиамминплатина (II) – оранжево-желтые кристаллы, хорошо растворимые в воде, а транс-дихлородиамминплатина(II) – кристаллы бледно-желтого цвета, растворимость которых в воде несколько ниже, чем у цис-изомера.
С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров. Для хлорида нитро(гидроксиламин)аммин(пиридин)платины(II) Cl получены все три изомера:
Октаэдрические комплексы могут иметь множество изомеров. Если в комплексном соединении такого рода все шесть лигандов одинаковы () или отличается от всех остальных только один (), то возможность различного расположения лигандов по отношению друг к другу отсутствует. Например, у октаэдрических соединений любое положение лиганда L ′′ по отношению к остальным пяти лигандам L ′ будет равноценным и поэтому изомеров здесь не должно быть:
Появление двух лигандов L ′′ в октаэдрических комплексных соединениях приведет к возможности существования двух геометрических изомеров . В этом случае появляются два различных способа расположения лигандов L ′′ друг относительно друга. Например, катион дигидроксотетраамминкобальта(III) + имеет два изомера:
При попытке найти какое-нибудь еще взаимное расположение лигандов H 3 N и OH - , которое отличалось бы от указанных выше, мы всегда придем к строению одного из уже приведенных.
При увеличении в комплексе числа лигандов, имеющих разный химический состав, число геометрических изомеров быстро растет. У соединений типа будет четыре изомера, а у соединений типа , содержащих шесть разных лигандов, число геометрических изомеров достигает 15. Подобные комплексные соединения пока еще мало изучены.
Геометрические изомеры существенно отличаются по физико-химическим свойствам, таким как цвет, растворимость, плотность, кристаллическая структура и т.д.

 I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
 БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
 С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
 Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
 II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
 III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен
III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен






 Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.
Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="Конформация >С ------- С Конформация >С ------- С
 Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="Цис- и транс-изомеры бутена-2 У каждого атома >C=C Цис- и транс-изомеры бутена-2 У каждого атома >C=C
 «по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным
«по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным




 E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
 а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)
а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)



 Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
 Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
 Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.
Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.






 Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.
Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.


 Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
 Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).
Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).



 Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)
Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)



 Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
 Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра
Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра

 Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.

 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.

 Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.
Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.

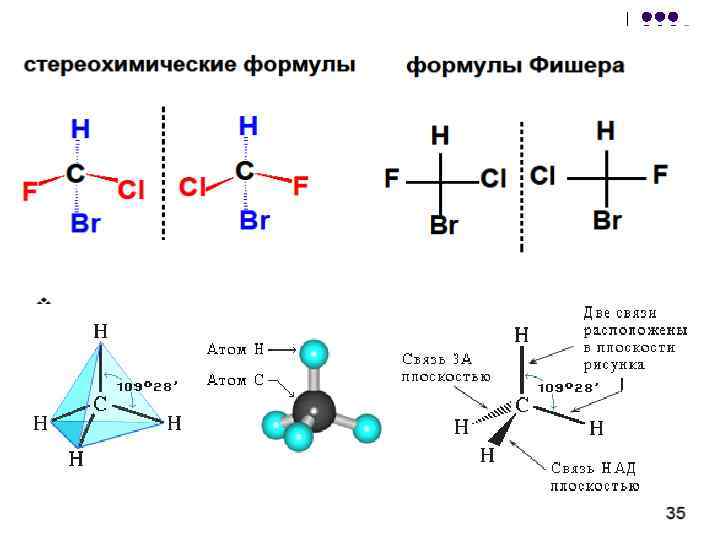
 Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
 (от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.
(от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.







 69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
Стереохимия алкенов. Методы синтеза.
Лекция 8
Вследствие жёсткости двойной связи (отсутствие вращения) замещённые алкены могут существовать в виде геометрических изомеров. Геометрические изомеры имеют одинаковое химическое строение (одинаковый порядок химических связей), но разное пространственное строение, т.е. они различаются конфигурацией. Это является причиной различия в физических и химических свойствах геометрических изомеров. В отличие от конформеров, геометрические изомеры при обычных условиях представляют собой устойчивые вещества, для их взаимного превращения необходима значительная энергия (125−170 кДж/моль). Наиболее простой пример – это 1,2-дизамещённые цис-,транс-изомеры этиленового ряда.
Слова цис- и транс- обозначают на латинском языке “по эту сторону” и “по ту сторону”. Как известно, ещё римские Цезари различали цисальпийскую и трансальпийскую Галлию. При чём, трансальпийская находилась за Альпами, на противоположной стороне от Римской империи. В приведённых примерах, очевидно, транс-изомерами называют те у которых одинаковые заместители находятся по разные стороны от плоскости двойной связи.
Ситуация с номенклатурой усложняется если в алкене присутствуют более двух заместителей при двойной связи. В этих случаях цис- ,транс-номенклатура неприменима и приходится пользоваться более общей (Z,E)-номенклатурой. В Z,E-системе старшинство определяется атомным номером заместителя непосредственно присоединённого к двойной связи. Если старшие заместители расположены по одну сторону от плоскости кратной связи, то изомер относят к Z-ряду (от нем. zusammen – вместе), если по разные то к E-ряду (от нем. entgegen – напротив). Если атомы, связанные непосредственно с ненасыщенными атомами углерода, одинаковы, то переходят к рассмотрению атомов “второго слоя”, при необходимости “третьего” и т.д.

При определении старшинства заместителей используются те же принципы, что и в номенклатуре КИП (см. (R,S)-номенклатура).
Несколько более сложных примеров, когда в соединении имеется несколько кратных связей, а также номенклатура сопряжённых диенов, замещённых алленов и сходных с ними классов органических соединений, приведено ниже.

В 1,3-диенах делокализация электронов π-систем повышает порядок центральной связи по сравнению с изолированной простой связью. И хотя центральная связь не становится двойной, она приобретает некоторую степень жёсткости, в результате чего повышается популяция одной из двух возможных конформаций, по сравнению с ожидаемым при свободном вращении вокруг С 2 -С 3 связи. В этом случае используют стереохимические обозначения s-цис- и s-транс. Очевидно, s-транс-конформация должна быть более выгодной по сравнению с s-цис-.
Конформеры сопряжённых диенов







